BT-001 är ett onkolytiskt virus som utvecklats med hjälp av Transgenes Invir.IO™-plattform och BioInvents teknologiplattformar n-CoDeR/F.I.R.S.T. BT-001 är designad för att generera både en Treg-avdödande human anti-CTLA-4-antikropp och humant GM-CSF-cytokin.
Användningen av ett onkolytiskt virus för att leverera anti-CTLA-4 lokalt och selektivt i tumörmikromiljön möjliggör höga koncentrationer av antikroppen i tumören, vilket ger ett starkare och effektivare antitumörsvar. Genom att minska den systemiska exponeringen till en mycket låg nivå förbättras säkerhets- och tolerabilitetsprofilen för anti-CTLA-4-antikroppen.
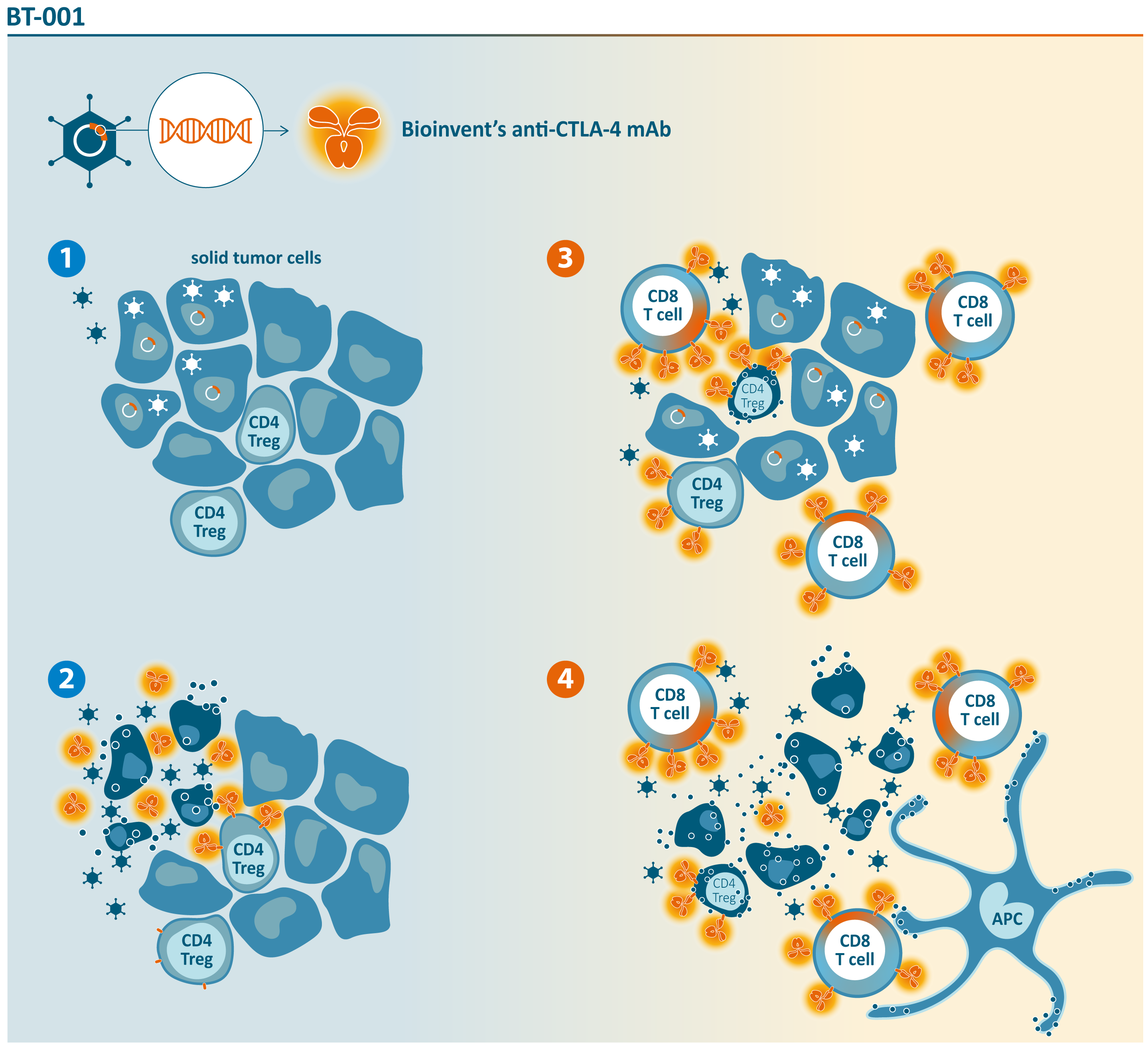
BT-001 är ett onkolytiskt virus laddat med BioInvents anti-CTLA-4-antikropp som frisätter anti-CTLA-4 lokalt i tumören
STATUS
Klinisk fas 1/2a-studie (NCT04725331)
I juli 2025 meddelades att BioInvent och Transgene gemensamt kommer att presentera en poster med uppdaterade data från fas
1-delen av fas 1/2a-studien av BT-001 vid European Society for Medical Oncologys (ESMO) årliga konferens som hålls i Berlin, Tyskland, den 17-21 oktober 2025. Titeln på abstractet är “Updated clinical results of BT-001, an oncolytic virus expressing an anti-CTLA-4 mAb, administered in combination with pembrolizumab in patients with advanced solid tumors”.
På ESMO 2024 presenterades en poster (Initial clinical results of BT-001, an oncolytic virus expressing an anti-CTLA4 mAb, administered as single agent and in combination with pembrolizumab in patients with advanced solid tumors) med data som visar att BT-001 inducerat tumörminskning hos patienter som inte svarat på tidigare anti-PD(L)-1-behandling, både som monoterapi och i kombination med MSD:s (Merck & Co., Inc., Rahway, NJ, USA) anti-PD-1-behandling pembrolizumab.
Preliminära translationella data indikerar att BT-001 replikeras i tumören utan att kunna detekteras i blod. BT-001 visade sig som
monoterapi, eller i kombination med pembrolizumab, tolereras väl och visade första signaler på effekt med klinisk respons hos 2/6 refraktära patienter, när det gavs i kombination med pembrolizumab. Behandling med BT-001 omvandlade ”kalla” tumörer till ”heta”, och inducerade T-cellsinfiltration, ett högre M1/M2-förhållande, samt PD(L)-1-uttryck i tumörens mikromiljö.
STUDIEDESIGN
Fas 1/2a-studien är en multicenter, öppen, doseskaleringsstudie som utvärderar BT-001 som monoterapi och i kombination med
pembrolizumab (anti-PD-1-behandling). Fas 1-komponenten av studien är uppdelad i två delar. I del A fick patienter med metastaserad/avancerad tumörsjukdom intratumorala administreringar av BT-001 som monoterapi. Del B undersöker intratumorala injektioner av BT-001 i kombination med pembrolizumab.
Den efterföljande fas 2a-komponenten av studien utvärderar kombinationsregimen i flera patientgrupper med olika typer av
tumörer. Denna breddning i indikationer ger möjlighet att utvärdera kombinationsbehandling för andra maligniteter som traditionellt inte får denna typ av behandling.
Läs mer om den pågående fas 1/2a-studien
Utvärdering av BT-001 enbart och i kombination med pembrolizumab
UTLICENSIERING OCH PARTNERING
I juni 2022 ingick BioInvent och Transgene ett samarbets- och leveransavtal för klinisk prövning med MSD, ett varumärke hos Merck
& Co., Inc., Rahway, NJ., USA, för att utvärdera BT-001 i kombination med MSD:s anti-PD-1-läkemedel KEYTRUDA® (pembrolizumab) i en klinisk fas 1/2a-studie för behandling av patienter med solida tumörer.
Sedan 2017 samarbetar BioInvent och Transgene för att utveckla läkemedelskandidaten BT-001 som kodar för både en differentierad och patentskyddad CTLA-4-antikropp och cytokinen GM-CSF. Forsknings- och utvecklingskostnader samt intäkter och royalties delas 50:50.


